임상시험의 이해 1. 신약개발 Process
khy4523@naver.com
2024.01.24
665
0
어떤 주제로 글을 써야 유익할까 많은 고민을 하다 임상시험과 CRO 업무에 대한 정보성 콘텐츠가 실질적인 도움이 될 것 같다는 생각을 하게 되었습니다.
아주 쉬운 내용부터 시작하여 한 단계 한 단계 올라가며, 취준생 여러분과 실무에 계신 분들께 도움이 될 수 있는 글을 공유하도록 노력하겠습니다.
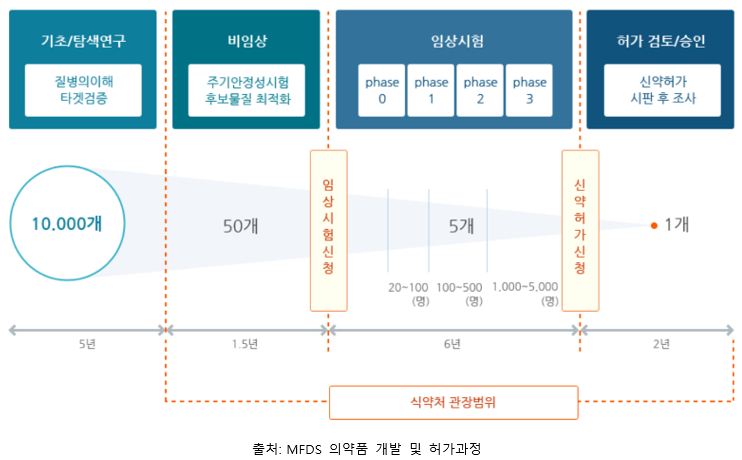
치료효과를 발휘할 수 있는 새로운 물질을 만들거나 기존의 물질을 변경하여 신약후보물질을 선정합니다.
선정된 신약후보물질로 동물을 대상으로 비임상 혹은 전임상시험을 진행하며,
이 단계에서는 사람에게 임상시험을 실시해도 안전하고 유효한지를 결정합니다.
쉽게 말해 약효와 기전 및 독성, 사람에게 투여할 때 안전한 용량 등에 대해서1차적으로 확인합니다.
임상시험 단계는 사람을 대상으로 하는 만큼
안전성과 윤리성이 보장되어야 하기 때문에 식약처로부터 임상시험계획에 대한 사전 승인을 받아야 합니다.
각 임상시험 단계에 대한 설명은 다음과 같습니다.
3상 임상시험까지 끝난 뒤에는 신약에 대한 안전성·유효성, 품질에 관한 입증자료를 식약처에 제출하여 시판허가(승인)를 진행합니다.
시판 후에는 장기간 효능, 안전성에 관한 사항을 평가하기 위해 제 4상 임상시험(Phase 4/PMS)을 진행하며,
이 단계에서 발견한 이상반응으로 인해 의약품 판매가 철회되기도 합니다.
끝으로, 긴 글 읽어주셔서 감사드리며 다음달에도 쉽게 다가갈 수 있는 유익한 내용을 준비해 보겠습니다. ^^

아주 쉬운 내용부터 시작하여 한 단계 한 단계 올라가며, 취준생 여러분과 실무에 계신 분들께 도움이 될 수 있는 글을 공유하도록 노력하겠습니다.
신약개발은 크게 ‘약물 발견’과 ‘임상시험’ 단계로 나뉘며,
좀 더 세분화하자면 1단계 Discovery, 2단계 비임상, 3단계 임상시험, 4단계 승인 으로 나눌 수 있습니다.
치료효과를 발휘할 수 있는 새로운 물질을 만들거나 기존의 물질을 변경하여 신약후보물질을 선정합니다.
선정된 신약후보물질로 동물을 대상으로 비임상 혹은 전임상시험을 진행하며,
이 단계에서는 사람에게 임상시험을 실시해도 안전하고 유효한지를 결정합니다.
쉽게 말해 약효와 기전 및 독성, 사람에게 투여할 때 안전한 용량 등에 대해서1차적으로 확인합니다.
임상시험 단계는 사람을 대상으로 하는 만큼
안전성과 윤리성이 보장되어야 하기 때문에 식약처로부터 임상시험계획에 대한 사전 승인을 받아야 합니다.
각 임상시험 단계에 대한 설명은 다음과 같습니다.
| Phase 0
= Early phase 1 |
소수(10명 내외)의 피험자를 대상으로 소량의 약물을 투여하는 시험으로, 본격적인 임상시험 전 신약의 효과와 안전성을 탐색 |
| Phase 1
(임상약리시험) |
20~80명 정도의 건강한 성인을 대상으로 하며, 약물의 체내동태, 약리작용, 부작용 및 안전하게 투여할 수 있는 투여량(내약량) 확인 |
| Phase 2
(치료적 탐색 임상시험) |
100~200명의 소규모 환자들을 대상으로 하며, 약효와 부작용을 평가하고 유효성 검증 3상 임상시험의 시험설계, 평가항목, 평가방법에 대한 근거 제공 |
| Phase 3
(치료적 확증 임상시험) |
수백~수천 명의 환자들을 대상으로 유효성을 입증/확증하고, 안전성 정보 등을 검토 시판허가를 위한 마지막 단계의 임상시험으로서 효능, 효과, 용법, 용량, 사용상의 주의사항 등을 결정 |
시판 후에는 장기간 효능, 안전성에 관한 사항을 평가하기 위해 제 4상 임상시험(Phase 4/PMS)을 진행하며,
이 단계에서 발견한 이상반응으로 인해 의약품 판매가 철회되기도 합니다.
| Phase 4
(치료적 사용 임상시험) |
시판 후 당국의 허가와 승인된 지침 아래 진행하는 실험적, 중재연구 시판 후, 유효성, 약물간 반응, 용량-반응 및 안전성 등을 추가적으로 조사 or 새로운 적응증 탐색 |
| PMS
(Post Market Surveillance) |
비중재적인 방법으로 진행 1상~3상에서 예측되지 않은 이상반응의 검토를 위해 시판 후 4~6년 동안 자료 수집 |





 List
List
